|
氧化还原反应的配平历来都是中学化学教学的重点和难点。教材上只介绍了简单的氧化还原反应的配平方法,而没有介绍复杂的氧化还原反应的配平方法。所谓复杂的氧化还原反应是指用来表示化合价变化的线桥不仅仅是一升一降,而是一升多降或多升一降或多升多降。对于复杂氧化还原反应的配平,其关键是:将多个线桥合并成一升一降两个线桥。这就是本文要介绍的复杂氧化还原反应配平法-----配比关系法。
配比关系法配平复杂氧化还原反应的关键问题寻找线桥之间的配比关系,即:通过一定的比例关系把几个线桥通过债券变成一升一降两条线桥。下面以化学方程式:FeS2+O2→Fe2O3+SO2的配平为例介绍这种配平方法。
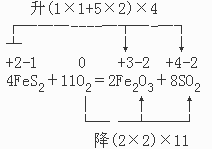
一、写出反应的方程式,标出元素的化合价。根据化学方程式和反应中各元素的化合价变化,找出全部的化合价变化的线桥。在这个反应中,共有三个线桥:
+2 +3 -1 +4 0 -2
①Fe→Fe ②S→S ③O→O
二、根据反应前后物质的组成和变化,找出线桥之间的配比关系。
从该反应前后的物质变化和FeS2的化学式可以看出,线桥①和②之间有确定的配比关系1:2。因此,可以将这两个线桥合并为一个线桥,即:当一个FeS2参加反应时化合价升高的数目为:Fe的化合价变化×Fe的配比数1+S的化合价变化×S的配比数2=1×1+5×2;另外,该反应发生时,最少要有一个氧气分子参加反应,故化合价最少要降低(2×2)。这样就得到一升一降两个线桥。
三、使化合价升高和降低的总数相等。
升(1×1+5×2)×4,所以FeS2的系数为4。
降(2×2)×11,所以O2的系数为11。
四、最后用观察法配平其它物质的系数。
得:
[例一]配平磷与硫酸铜溶液反应生成磷化亚铜、磷酸和硫酸的化学方程式。
写方程式,标化合价,找化合价变化的线桥。
0 +2 +1-3 +5
P+CuSO4+H2O→Cu3P+H3PO4+H2SO4
0 -3 +2 +1 0 +5
P→P Cu→Cu P→P
从方程式和磷化亚铜的组成可以看出:
0 -3 +2 +1
P→P 与 Cu→Cu之间有配比关系:1:3。据此配平如下:
降(3×1+1×3)×5
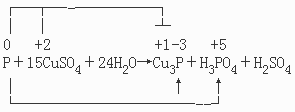
升5×622+N2
从方程式和硫化钾的组成可以看出:
+5 0 0 +4
N→N与S→S之间存在配比关系:2:1。(这是因为K与N之比为1:1,K与S之比为2:1,所以N与S之比为2:1。)
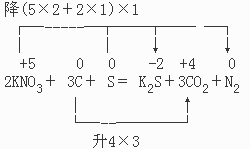
通过上面的举例,可能造成一个错觉,就是总是升与升合并,降与降合并。这是不是配平的规律呢?回答是否定的,尽管有不少的复杂氧化还原反应可以这样合并。比如下面的例子。
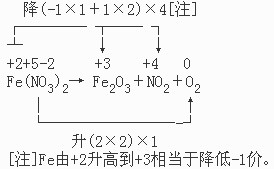
[例三]配平方程式:Fe(NO3)2→Fe2O3+NO2+O2
从反应式和Fe(NO3)2的组成可以看出:
+2 +3 +5 +4
Fe→Fe与 N→N之间存在配比关系:1:2。合并后配平,得:
配比关系法是配平复杂氧化还原反应方程式的重要方法,是对教材上的氧化还原配平法的重要补充与发展,但它并不是万能的。对配平下面的反应就显得无能为力。
[例四]配平方程式:KI+H2S+KIO3--I2+K2SO4+H2O
在此反应中,有三条线桥:
-1 0 -2 +6 +5 0
I→I S→S I→I
但是难以找出配比关系。对这类反应可以用未知数法。为种方法不同于待定系数法,因为这种方法的配平依据仍是经合价升降总数相等。
设:KI的系数为x,H2S的系数为y,用观察法可知:KIO3的系数为(2y-x),I2的系数为y,K2SO4的系数为y,H2O的系数y。化学方程式变为2:
xKI+yH2S+(2y-x)KIO3=yI2+yK2SO4+yH2O
根据“在氧化还原反应中,化合价升降总数必然相等”的原则
,可以得出如下方程式:
[0-(-1)]×x+[6-(-2)]×y=(5-0)×(2y-x)
解得:y=3x
将y=3x代入上面的化学方程式,化简得:
KI+3H2S+5KIO3=3I2+3K2SO4+3H2O
[练习]配平下列化学方程式:
⑴Cu(IO3)2+KI+H2SO4→CuI+I2+K2SO4+H2O
⑵Fe3P+HNO3→Fe(NO3)3+H3PO4+NO+H2O
⑶Fe2++Brˉ+Cl2→Fe3++Br2+Clˉ
⑷Ag3AsO3+Zn+H2SO4→Ag+AsH3+ZnSO4+H2O
⑸As2O3+S+HNO3+H2O→H3AsO4+H2SO4+NO
注:此文发表于《新疆中学化学优秀论文集》新疆青少年出版社(2002年第1版) |





 网友评论:(只显示最新10条。评论内容只代表网友观点,与本站立场无关!)
网友评论:(只显示最新10条。评论内容只代表网友观点,与本站立场无关!) 